(中文)
生物制剂质量控制:如何控制注射剂可见异物?(上篇)
药典规定“可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm”,同时指出“在静置一定时间后轻轻地旋转时均不得检测出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2mm的纤维和块状物等明显可见异物”。
01 注射剂的可见异物对人体的危害
注射剂中的可见异物对人体构成的潜在危害是多方面的,注射剂中的可见异物若来源于外源,例如生产过程中的污染,它们可能会随血液循环而无法被人体代谢,从而可能引发一系列潜在的健康风险,包括炎症反应、血管损伤、肉芽肿形成、血管栓塞、热原反应、过敏反应等,甚至可能导致肿瘤或肿瘤样反应,以及全身性感染,严重威胁患者的用药安全。然而,如果可见异物是内源性的,比如来源于药物成分本身,它们有可能被人体代谢系统处理,因此可见异物的风险性需要考虑异物的来源和性质。
02 生物制品灯检的重要性
注射剂中的可见异物检查不合格以及由此引起的药品召回事件是一个全球性的问题,美国FDA发布的2017年5月~2022年5月近5年共344起药品召回事件中,涉及可见异物不合格的高达30起,占比9.0%,平均每年发生6起召回,仅次于微生物污染(50起)。
我国《药品生产监督管理办法》第五十五条(二)规定:监管部门对疫苗、血液制品、放射性药品、医疗用毒性药品、无菌药品等高风险药品生产企业,每年不少于1次药品生产质量管理规范符合性检查。如果市场抽检发现可见异物超标将被判定为劣药,将会对产品进行召回,并按照《中华人民共和国药品管理法》第一百一十七条规定:处违法生产、销售的药品货值金额十倍以上二十倍以下的罚款……情节严重的,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证、药品经营许可证或者医疗机构制剂许可证。为依法开展注射剂类药品生产风险防控检查提供了法律保障。
03 灯检流程及常见异物来源分析
为确保药品质量并降低临床风险,应在产品开发过程对可见异物进行风险评估。采用适当的分析技术识别出典型可见异物并对其尺寸、数量及组成成分等进行鉴定,进一步追溯其潜在来源并评估风险等级,从而有针对性地制定可见异物控制策略。通常固有异物、内源性异物与外源性异物可能引发的风险呈逐渐增加趋势,风险降低措施也应逐渐强化和全面。
3.1 注射剂中分析常见的可见异物来源
可见异物可以分为三类:固有异物、内源性可见异物和外源性可见异物。可见异物的检出是一个概率事件,多种因素都会影响到检出的概率。例如,注射剂的类型(液体、固体)、产品的配方(成分的性质和浓度)、异物的属性(大小、形状、材质)、容器或包装材料的品质,以及实施检查的人员和检查条件等因素都可能对检出概率产生影响。
 供试品中如检出点状物、2mm以下的短纤维和块状物等微细可见异物,生化药品或生物制品若检出半透明的小于约1mm的细小蛋白质絮状物或蛋白质颗粒等微细可见异物,除另有规定外,生物制品注射液、滴眼剂结果判定应分别符合下表中的规定:
供试品中如检出点状物、2mm以下的短纤维和块状物等微细可见异物,生化药品或生物制品若检出半透明的小于约1mm的细小蛋白质絮状物或蛋白质颗粒等微细可见异物,除另有规定外,生物制品注射液、滴眼剂结果判定应分别符合下表中的规定:

注射用无菌制剂:
· 5支(瓶)检查的供试品中如检出微细可见异物,每支(瓶)中检出微细可见异物的数量应符合下表中的规定;
· 如有1支(瓶)超出下表中限度规定,另取10支(瓶)同法复试,均应不超出下表中限度规定。
 无菌原料药:
无菌原料药:
· 5份检查的供试品中如检出微细可见异物,每份供试品中检出微细可见异物的数量应符合相应注射用无菌制剂的规定;
· 如有1份超出限度规定,另取10份同法复试,均应不超出限度规定。
3.2 常见的灯检方式有哪些?
生产过程中应采用经过确认的方法对注射剂进行100%灯检并剔除不合格品,并应在最易检测到可见异物的工序进行检查,例如:一般应在贴标签前进行可见异物检查,以避免标签的影响。当前,常用的可见异物检查方法包括人工灯检、半自动化检查与自动化检查。《中华人民共和国药典》(China Pharmacopeia, ChP)中收载了灯检法与光散射法,其中光散射法属于自动化检查范畴;欧洲药典(European Pharmacopoeia, EP),日本药典(Japanese Pharmacopoeia, JP)均仅收载了灯检法。
3.2.1 人工灯检
人工灯检是通过人眼视力直接分辨异物,是目前可见异物检查最常见也是最主要的方法,各国药典均有收载。人工灯检的关键参数主要包括:
①背景和对比,采用黑色或白色的纯色背景板提供对比,以最大化产品内容物的可见性。
②光照度与检查时间,需结合包装容器颜色与产品特性等选择合适的光照度,并保证每个容器都有足够的检查时间;
③需仔细旋转或倒置内容物,确保容器和瓶塞内表面的可见异物得到充分检查,溶液型注射剂还应尽量避免引入气泡,以减少检测误差。
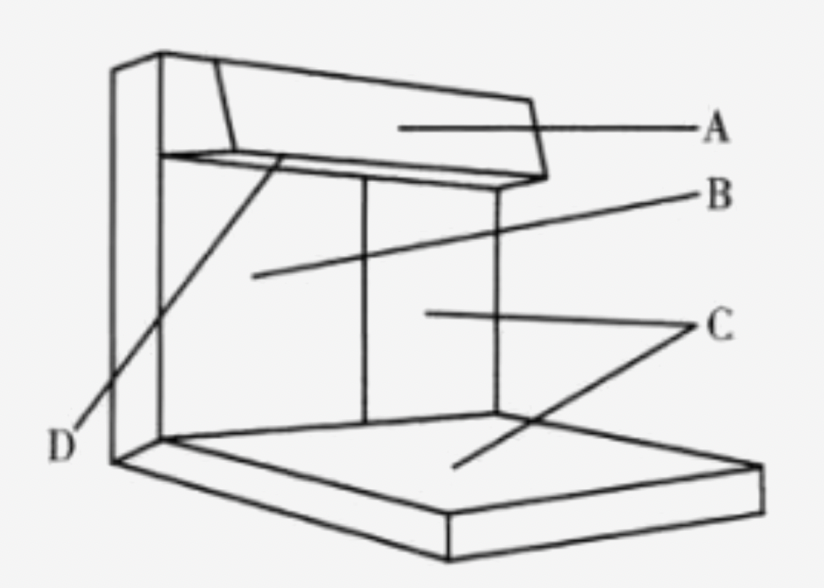 A.带有遮光板的日光灯光源(光照度可在1000~4000lx范围内调节);
A.带有遮光板的日光灯光源(光照度可在1000~4000lx范围内调节);
B.不反光的黑色背景;
C.不反光的白色背景和底部(供检查有色异物);
D.反光的白色背景(指遮光板内侧)。
图1 灯检法示意
3.2.2 半自动灯检机
半自动化检查技术将自动化容器处理技术与人工灯检结合,在机械支持下,容器可以在检查者面前以恒定速度上下翻转或旋转,停止后检查者通过放大镜观察容器中的可见异物,机械或手动剔除不合格品。半自动化检查技术与人工灯检工作原理相同,关键参数相似,但检查速度需经过确认,工作效率明显提高。
3.2.3 全自动灯检机
自动化检查技术采用与半自动化检测技术相似的自动化容器处理技术,检测技术由“人工检查”发展为“自动化检查”。常见的自动化检查技术主要包括高速工业相机、可见光二极管阵列、X⁃射线、近场雷达、紫外和近红外光谱等,通过不同波长和传感器检测可见异物,并自动剔除。ChP中的光散射法(第二法)即利用注射剂中的可见异物使入射光发生散射的原理,通过检测光散射能量,达到检查注射剂中可见异物的目的。与人工灯检和半自动化检查技术相比,自动化检查技术不仅提高了工作效率,降低了检查变异性,还提高了灵敏度和可靠性,甚至可以检测到比目检阈值下限更小的可见异物。
3.3 人工灯检的流程和标准
可见异物是注射剂一项重要的质量控制指标,国内外药品审评及监管机构都高度关注注射剂中可见异物的检查和控制。国内外药典均规定注射剂应对可见异物进行检查,并制定了可见异物检查方法通则,包括检查方法和结果判定标准。
ChP规定注射剂不得检出明显可见异物,对于点状物、2 mm以下的短纤维和块状物等微细可见异物也根据不同类型药物和不同给药途径制定了相应的可接受标准。美国药典(United States Pharmacopeia, USP)规定注射剂应基本不含可见异物,EP和JP对注射剂中可见异物的要求与USP相似。同时各国药典和相关技术要求均明确注射剂生产过程中应对可见异物进行100%检查并同时剔除不合格产品。美国FDA于2021年12月发布了《注射剂可见异物检查行业指南(草案)》,以下简称FDA指南草案,系统阐述了基于风险评估与生命周期管理的整体可见异物检查和控制策略,同时提出应在严格确保注射剂生产符合GMP要求的基础上,建立整体的控制策略。
表1 各国药典注射剂中可见异物灯检法比较

 鼎康生物拥有3条制剂灌装线,包含1条小容量注射剂线、1条冻干粉针剂线和1条预灌封注射剂线,全部采用隔离器技术,其中小容量注射剂线已2022年1月通过GMP现场核查,成为国内先进的具有商业化生产能力的CDMO企业。目前生产线满足中国NMPA、欧盟EMA、美国FDA和PIC/S GMP的要求来生产液体无菌产品。生产过程中,我们的生产操作以及设备设施监测都是“7x24hrs ”,灯检过程采用2次100%人工灯检,之后进行AQL取样,确保灯检过程的有效性。
鼎康生物拥有3条制剂灌装线,包含1条小容量注射剂线、1条冻干粉针剂线和1条预灌封注射剂线,全部采用隔离器技术,其中小容量注射剂线已2022年1月通过GMP现场核查,成为国内先进的具有商业化生产能力的CDMO企业。目前生产线满足中国NMPA、欧盟EMA、美国FDA和PIC/S GMP的要求来生产液体无菌产品。生产过程中,我们的生产操作以及设备设施监测都是“7x24hrs ”,灯检过程采用2次100%人工灯检,之后进行AQL取样,确保灯检过程的有效性。
1. 小容量注射剂(2mL、6mL、10 mL、15 mL、20 mL、50mL):采用先进的进口生产线,具备100%在线称重功能。
2. 冻干粉针剂(2mL、6mL、10mL、20mL):配备全自动联动线和25平方米冻干机,具备100%在线称重功能。
3.预灌封注射剂(1mL、2.25mL):配备自动拆包机器和PFS灌装机,具备机械臂自动取样称重功能。
参考文献:
[1] 张芸,王亚敏.注射用冻干制剂新药申报中的药学常见问题和基本考虑[J].药物评价研究, 2023, 46(9):1848-1853.
[2] 注射剂可见异物产生的原因和检查方法
(https://www.ouryao.com/blog-719835-47381.html)
[3] 注射剂可见异物控制指导原则 附件 1:注射剂可见异物控制指导原则(新增)公示稿(第一次)
[4] 中国药典2020 版 三部通则 0904 可见异物检查法
[5] 陆仕华,李杉,蒋明艳,等.注射剂类药品生产风险防控检查的分析与改进对策[J].中国医药工业杂志, 2022, 53(10):1516-1521.DOI:10.16522/j.cnki.cjph.2022.10.020
[6] 李越,董武军,张耀,等.美国FDA《注射剂可见异物检查行业指南(草案)》介绍与解读[J].中国新药杂志, 2023, 32(13):1309-1314.
[7] 杨华,王有芳.制药工艺项目质量控制存在的问题及完善措施[J].中文科技期刊数据库(引文版)医药卫生, 2022(4):3.
关于鼎康生物
鼎康生物是一家全球领先的CDMO公司,率先引进了全球首个模块化生物制药工厂KUBio,赋能生物制品从细胞株开发到商业化生产的全过程。我们位于上海的创新中心聚焦高效的细胞株开发和先进的技术开发,与拥有多国临床试验申请和新药上市成功经验的武汉制造工厂相结合,鼎康生物正在为全球生物医药客户提供一站式的CMC解决方案。在鼎康生物,我们有一个共同的目标, 致力于提高前沿生物医药对全球患者的可及性,履行我们对人类健康的承诺。如需了解更多信息,请访问: www.chimebiologics.com。


