浅谈抗体药物生产中的难点和应对策略

自21世纪伊始,全球生物制药产业便迎来了快速增长。截止2022年12月,全球已有100多款嵌合、人源化和人源的单克隆抗体药物获得FDA批准并进入临床应用。2024年上半年全球畅销药榜单中,单克隆抗体药物继续占有重要地位。然而,将实验室研发的抗体转化为可大规模生产的药物并非易事。在这一过程中,面临众多挑战和难点,需要选择和制定应对策略,以确保药物的高质量生产和市场供应。
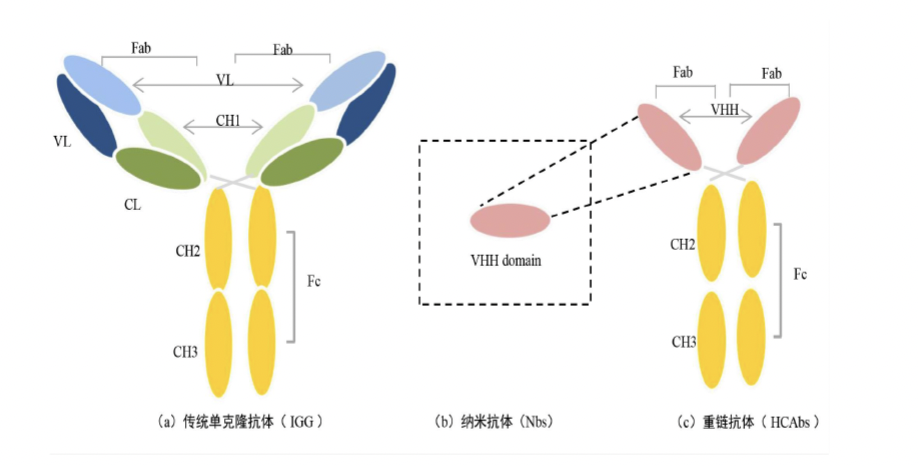
图1 单克隆抗体、纳米抗体、重链抗体的结构示意图
01 抗体商业化生产的难点
单抗类药物生产是个非常复杂的过程,工业化生产阶段大致分为上游发酵、下游纯化和制剂灌装阶段。抗体的生产涉及到细胞培养、蛋白表达、纯化和结构分析等多个关键环节。这些环节环环相扣,任何一步的失误都可能导致生产失败或产品质量的降低。因此,确保每一步骤的稳定性和可重复性对于成功生产和维持产品质量来说至关重要。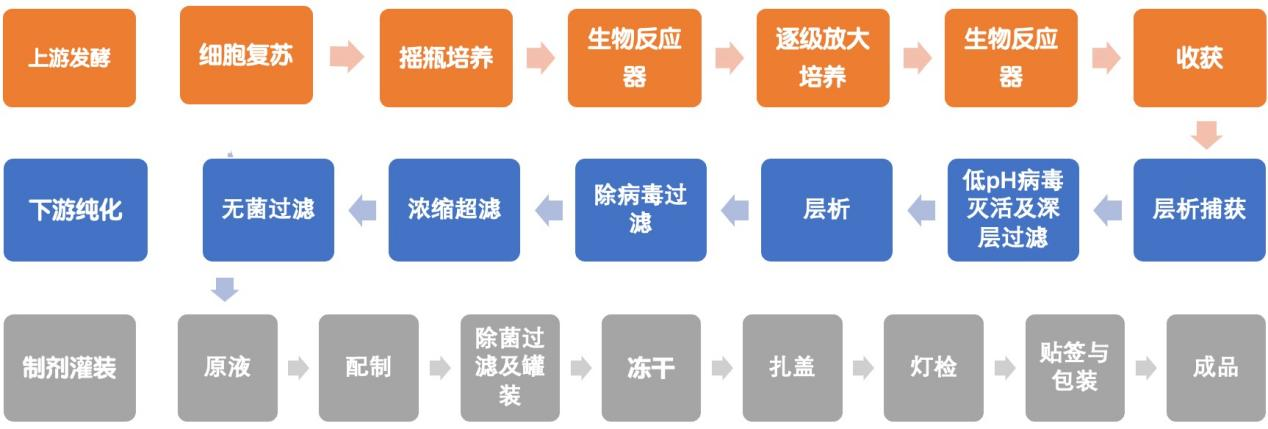
图2 一般抗体药物生产流程图
1 上游生产阶段的挑战
抗体药物的开发是一个极其复杂的过程,其中构建适用于工业生产的高表达细胞株是第一步,也是为关键的步骤之一。这一步骤直接影响到生产的效率以及最终产品的质量。根据不同公司的研发实力,从细胞株筛选到细胞培养工艺开发完成通常需要6到12个月,有时甚至更长的时间。尽管细胞株构建在整个抗体生产成本中所占比例较小,但在提高大规模生产的产量方面却扮演着极其重要的角色。目前,大多数抗体药物都是由CHO细胞(中国仓鼠卵巢细胞)进行表达的。开发能够稳定表达高产量和高质量抗体的细胞株,是工业化生产抗体药物的核心目标之一。
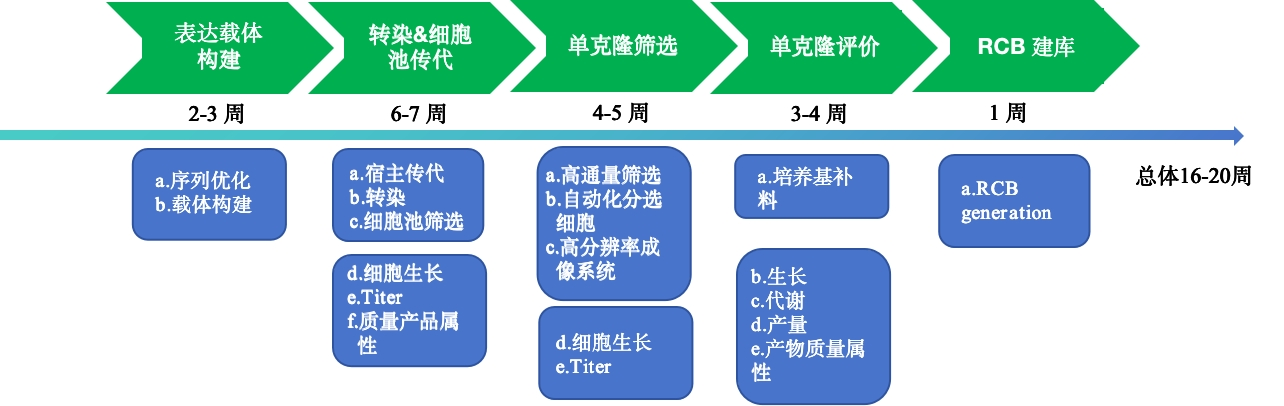
图3 工程细胞株的构建过程
为了解决这些问题,研究人员正在不断探索创新的解决方案。他们引入高表达细胞株、优化培养条件以增加抗体表达量;开发高通量筛选技术和快速创新平台以提高效率。例如,在细胞株开发方面,鼎康生物开发了具有自主知识产权的和高表达的CHO表达系统,表达量超过10g/L,同时利用先进的单细胞打印机和高分辨率成像系统,确保单克隆细胞的单一性,同时单细胞株构建时间可以缩短至3.5-4个月。所有细胞株的生产和单克隆性均符合法规要求,具有完整的记录和可追溯性。不仅如此,鼎康生物也能在合作伙伴的Discovery阶段接入,利用CMC平台帮助进行候选分子的可开发性研究,缩短开发周期,减少项目CMC阶段开发的风险,以稳健的工艺,高效的生产将分子快速的推进临床。目前,已成功完成了30多项新药项目的工艺转移及工艺优化。
在抗体药生产工艺开发过程中,规模化生产是关键,在抗体的大规模生产过程中,作为上游工艺核心的细胞培养和发酵工艺,是需要企业投入大量人力和物力的,这直接关系到生产率。动物细胞对培养微环境的改变非常敏感,反应器放大过程中经常遇到剪切力、O2供给、CO2排除和pH控制等问题。剪切力的控制可以通过降低搅拌转速或使用剪切保护剂来实现,而O2供给和CO2排除则可以通过优化通气和搅拌策略来解决。pH控制需要考虑混合时间和碱液补加位置。同时实施实时或近实时的监控系统,以跟踪关键工艺参数和产品质量属性。使用先进的分析技术来评估细胞生长、代谢产物和杂质水平。工艺放大过程中,需要逐步放大并评估每个阶段的工艺参数和杂质水平的稳健性,以确保工艺在放大过程中的一致性和可靠性。
2 下游生产阶段
生物制药下游生产工艺目的就是把目标药物分子从复杂发酵液体系中分离出来以满足药品纯度及质量的需求。随着上游技术的进步,单克隆抗体的生产能力已经从每升几毫克转变为几克。与上游十多倍生产效率提升相比,抗体主要生产成本也转移到下游。因此如何经济、高效的从发酵的复杂组分中浓缩、分离和纯化目标生物分子已成为全球抗体药生产的共同目标。

图4下游纯化面临的主要挑战
层析技术是抗体药物生产中的关键步骤,特别是在下游纯化过程中。成功的放大操作需要考虑层析工艺参数的线性放大、设备选择、GAP FEMA分析以及放大确认和参数微调。从小试规模到中试级别可能需要50-100倍的放大,而从中试级别到商业化生产规模则需要10-50倍的放大。Protein A介质是下游分离纯化的瓶颈所在,改进Protein A介质性能,如提高载量和使用寿命,或采用连续层析工艺技术,与传统的批次层析相比,连续层析可以提高生产效率和介质的利用率,从而降低成本。
通常情况下,通过对工艺和参数的充分评估和合理优化便可以大规模高效生产任何抗体。在评估过程中,需要重点关注的关键参数包括层析填料的性能、层析柱的尺寸、缓冲液的需求等。在商业规模生产之前,必须对这些工艺要求、空间利用、工艺效率和先进制造系统进行充分的评估和测试,以避免在商业化规模生产中出现不可控的结果。同时,如果在生产设施的设计阶段不能合理确定这些关键参数,可能会导致工艺失败,甚至造成商业损失和延迟产品上市。
对于当前研究热点之一的连续流层析法,其主要瓶颈之一在于病毒灭活/清除验证步骤的放大困难。在小规模生产中,可以直接添加指示病毒来验证病毒灭活/清除的效果。但是,在采用连续流层析法进行商业化生产时,如果仍采用相同的条件来验证病毒灭活/清除效果,将会非常复杂。因此,需要开发更高效的规模缩小模型来解决这个问题。
随着监管部门对抗体药的纯度和质量要求越来越高,同时用于治疗用的生物分子种类越来越多,结构越来越复杂,且生物分子对外部条件敏感,稳定性差,杂质多,使得生物制药分离纯化的挑战更大,同时对于抗体药物生产过程的监测和控制系统技术的不足之处越来越明显。随着复杂性、非线性程度和数字化程度的增加,迫切需要更有效的先进过程控制,以避免资金、时间成本的浪费,降低失败的风险。在这一方面,鼎康生物引领行业创新,采用全球首个生物制药模块化工厂——KUBio,实现了全天候的工程保障。这一突破性技术确保了生产过程可以按照"24/7"的模式,即每周7天、每天24小时不间断地进行连续生产操作。在提高生产效率的同时,鼎康生物也严格保证了产品质量的稳定性和一致性,展现了其对工艺连续性和产品质量的双重承诺。

02 高成本的生产
抗体药不同于传统化学药品,不同创新程度与不同治疗领域的抗体药成本价格差异较大。抗体药自身特性决定了其研发生产流通各环节成本构成均有别于传统化学药品。
a) 研发成本高:抗体原研药品总研发成本可以高达12亿美元,抗体类似药(biosimilar)研发成本约为0.75-2.5亿美元。
b) 生产及流通成本高:抗体药必须具备生物合成与复杂三级结构(许多是大分子蛋白质)这两个基本要件,这决定了其制造过程固定资产投入高,储存流通成本也远高于其他药物。
c) 人工成本高:抗体药物的生产成本通常较高,主要是由于生产过程复杂、需要大量的人力资源和设备投入。这使得抗体药物的价格较高,限制了其在市场上的竞争力。
降低生物制药成品的成本是一个复杂的过程,涉及多个方面,包括研发、生产、供应链管理、质量控制等。以下是一些可能的策略:
a) 研发阶段的成本控制:优化分子设计,减少后期生产和纯化的成本。利用计算生物学和生物信息学工具预测和优化分子的稳定性和表达量。
b) 生产过程的优化:采用高产量的细胞株和表达系统,如鼎康生物所使用的CHO-K1细胞株。优化培养条件和生物反应器的设计,提高生产效率。实施连续生产流程,减少批次间的准备和清洁时间。
c) 工艺放大和规模化生产:通过工艺放大,实现从实验室规模到工业规模的平稳过渡,降低单位成本。采用自动化和机器人技术减少人工成本和提高一致性。
d) 人工成本的控制:选择合适的企业地点。例如湖北武汉,相对上海、苏州,有着天然优势。一方面是因为人力成本相对较低,但更主要的是人才资源的丰富性与人员的稳定性。魏建中表示,中国生物制药领域的很多人才都出自武汉、湖北,这为企业扩张产能提供了源源不断的人才支持,并且武汉人才的稳定性也更高
e) 质量控制和保证:通过严格的质量控制减少不合格产品,避免浪费。采用先进的分析方法,确保产品质量,减少返工和重新生产。
f) 法规遵从和文件管理:确保所有操作符合监管要求,避免因违规而导致的额外成本。优化文档管理系统,减少因文件问题导致的延误和成本。
g) 技术和设备的更新:投资于新技术和设备,提高生产效率和降低长期运营成本。定期维护和升级设备,以避免因设备故障导致的生产中断。
h) 合作和外包:与专业服务提供商合作,利用其专业知识和经验降低研发和生产成本。外包非核心活动,专注于公司的核心优势。
03 结语
随着生物药品全球销售额的增加,畅销的药物往往来自于生物药工艺,加之生物类似药竞争,价格成为未来生物药市场竞争的关键因素。药品的成本直接决定了其价格,因此如何提高产量、降低成本成为生物制品开发的重中之重。
大多数抗体药物是人源化抗体,通过将小鼠单克隆抗体的互补性决定区(CDR)移植到人抗体中构建而成,这意味着抗体药物几乎具有相同的物理和化学性质。因此,有可能实现抗体药物生产过程的标准化。抗体药物制造平台的一般流程包括上游和下游过程,这些过程大多是批量型的,在符合药品生产质量管理规范(GMP)的药品制造现场进行控制。由于抗体制造过程的标准化,制造设备、外围辅助材料和原料系统也可以实现标准化。这为生物制药公司将其制造外包给生物制药CDMO公司提供了便利。在选择合适的CDMO公司时,可以极大地缩短研发周期并降低研发成本,以实现高效、成本效益高的生物制品开发。
04 展望
在生物制药行业,无论是在药物发现还是制造过程中,都经历了大量的技术创新。与此同时,药品行业的水平分工模型变得越来越重要;生物制药公司(和生物技术公司)更多地专注于药物发现和发展,而CDMO公司则更多地专注于工艺开发和制造。在抗体商业化生产面临的各种挑战面前,企业需要全面考虑技术、市场、法规等多个方面的因素,制定合理的应对策略。这包括选择合适的生产技术,优化工艺流程,确保产品质量,同时也要考虑市场需求、定价策略和法律法规的影响。只有通过不断的创新和改进,企业才能在竞争激烈的抗体药物市场中脱颖而出,为患者提供更高质量和更有效的治疗方案。这要求企业保持对新技术发展的关注,加强与CDMO的合作,以及积极应对市场和法律环境的变化,以确保其产品和服务能够满足患者的需求,同时也能在商业上取得成功。

参考文献
[1] Rahban M, Ahmad F, Piatyszek MA, Haertlé T, Saso L, Saboury AA. Stabilization challenges and aggregation in protein-based therapeutics in the pharmaceutical industry. RSC Adv. 2023 Dec 11;13(51):35947-35963. doi: 10.1039/d3ra06476j.
[2] Chahar DS, Ravindran S, Pisal SS. Monoclonal antibody purification and its progression to commercial scale. Biologicals. 2020 Jan;63:1-13. doi:10.1016/j.biologicals.2019.09.007. Epub 2019 Sep 23. PMID: 31558429.
[3] Kurata H, Ishino T, Ohshima Y, Yohda M. CDMOs Play a Critical Role in the Biopharmaceutical Ecosystem. Front Bioeng Biotechnol. 2022 Mar 21;10:841420. doi: 10.3389/fbioe.2022.841420. PMID: 35387299; PMCID: PMC8978586.
关于鼎康生物
鼎康生物是一家全球领先的CDMO公司,率先引进了全球首个模块化生物制药工厂KUBio,赋能生物制品从细胞株开发到商业化生产的全过程。我们位于上海的创新中心聚焦高效的细胞株开发和先进的技术开发,与拥有多国临床试验申请和新药上市成功经验的武汉制造工厂相结合,鼎康生物正在为全球生物医药客户提供一站式的CMC解决方案。在鼎康生物,我们有一个共同的目标, 致力于提高前沿生物医药对全球患者的可及性,履行我们对人类健康的承诺。如需了解更多信息,请访问: www.chimebiologics.com。


