生物制药技术转移实施要点

新冠疫情之后,全球公共卫生领域对各种先进技术和产品的需求更加迫切,且在满足合规性和控制风险的前提下,对时效性的要求更高。此外,疫情对经济和资本市场造成了重大冲击,许多创新型中小医药企业面临生存和发展困境。因此越来越多的生物制药公司正在寻求CDMO(Contract Development and Manufacturing Organization)公司的支持,即发生技术转移。CDMO公司利用尖端的技术,专业的知识和“行业全球化”的观念,帮助企业降低生产成本,获得新的增长点和竞争力,促进企业的复苏和发展,推动各个中小型企业尽快将项目推进上市。
根据ICH(International Council for Harmonization,国际人用药品注册技术协调会)Q10[1]的药品质量体系模型,技术转移行为的目的是将产品和工艺知识在开发和生产之间进行转移,并且在生产区域内或生产区域间传递以实现产品的生产。本文将结合当前技术转移业务的发展现状与相应法规要求,简单介绍技术转移的复杂性、发生流程以及技术转移发生后的可比性研究,以帮助从业者更好地实现技术转移。
01 技术转移的复杂性
根据不同产品所处的不同研制阶段、相应工艺的成熟程度和技术转移范围等不同因素都会引起技术转移方案的不同,即技术转移的复杂性。本文结合不同维度的决定因素,并结合示例案例和风险考虑为从业者提供计划和制定技术转移的思路。具体信息见表1。
表1.导致技术转移具有复杂性的因素[2]
 由上表可知,一个项目的技术转移对象、转移目的以及项目所处的研制周期和现阶段项目的工艺成熟程度等,均是导致技术转移具有复杂性的因素。从业者应在技术转移发生前,详细梳理项目所处阶段和预期达到的转移目的,避免出现委托研究不足或者研究重复的问题。
由上表可知,一个项目的技术转移对象、转移目的以及项目所处的研制周期和现阶段项目的工艺成熟程度等,均是导致技术转移具有复杂性的因素。从业者应在技术转移发生前,详细梳理项目所处阶段和预期达到的转移目的,避免出现委托研究不足或者研究重复的问题。
02 技术转移的流程
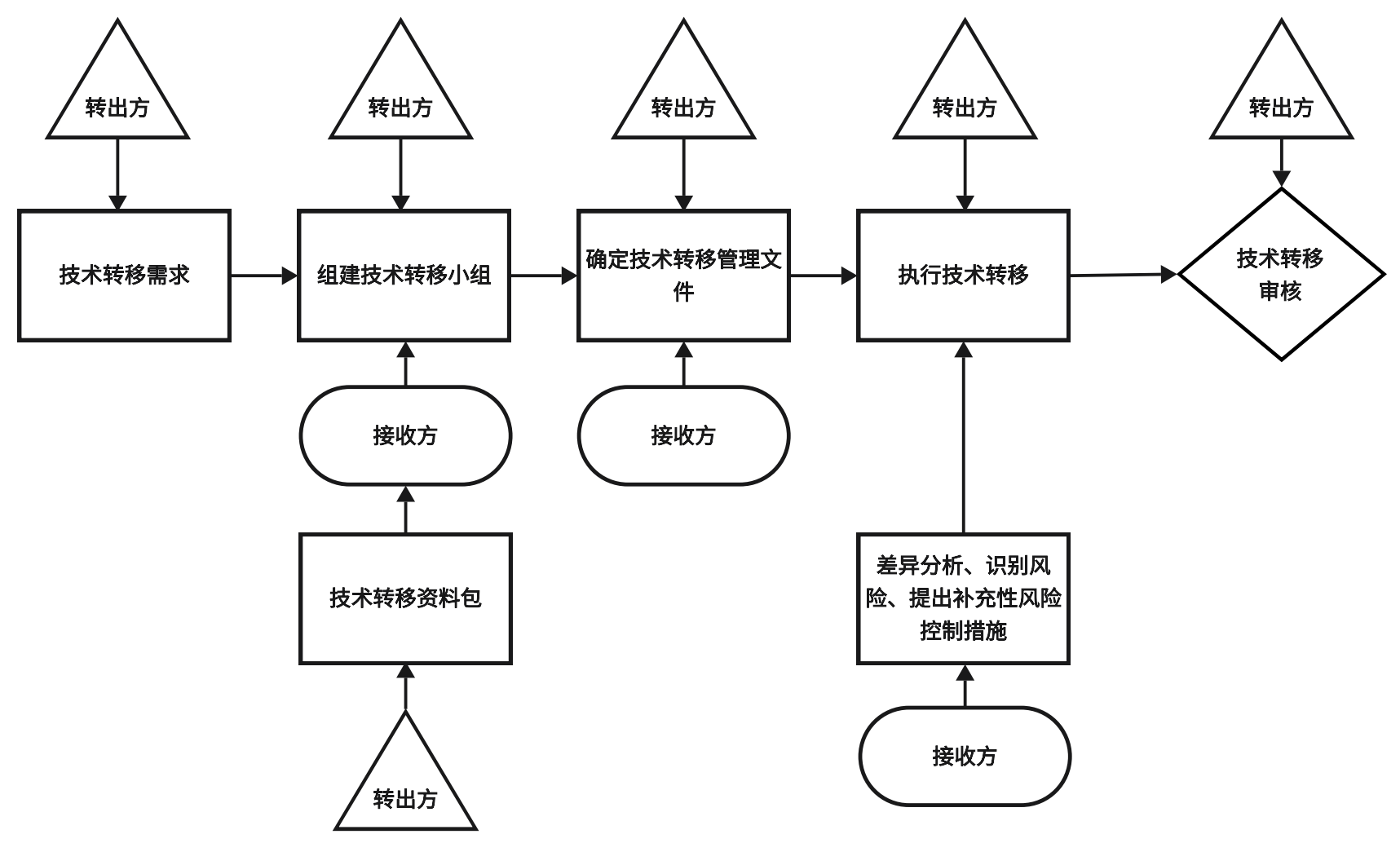
图1.技术转移一般流程
随着技术转移的发生,不同阶段中可能会产生相应的问题和难点,本文列举几点供从业者参考。首先,在转出方考虑技术转移需求时,应选择合适的CDMO公司,从生产规模、能力与声誉、忠实于时间和可交付成果、供应链保障和项目管理资源等方面考察接收方是否有能力承接技术转移工作。其次,在转出方准备技术转移资料包时,除开提供全套前期开发操作SOP(Standard Operating Procedure)外,还需尽可能延申相关原理文件,例如细胞培养基配制,部分SOP在配制过程中仅将pH的调控结果规定为范围值,若培养基粉剂为酸性条件溶解,则配制过程需尽量达到范围下限,若分级为碱性条件溶解,则反之,相关配制原理文件帮助接收方工作人员理解工艺,降低风险。
另外,在技术转移过程中,转出方和接收方出现的任何差异都可能会给产品的实现带来潜在的风险,例如,可能延长技术转移时间、增加技术转移活动的费用、影响转移产品的质量等。差距分析是风险评估的一种,通过识别接收方现有情况与转出方的技术要求或预期标准之间的差距,并提出相应的控制措施,确保产品引入的过程规范。在制定技术转移方案之前由转出方和接收方各领域的主题专家组建差距分析小组开展技术转移差距分析活动。差距分析接收方为主,转出方辅助,从“人、机、料、法、环、测”等方面对于技术转移过程进行对比分析。
03 技术转移的可比性
技术转移的需求可能发生在产品的整个生命周期中,从业者需要明白,在产品研制生命周期的各阶段发生的技术转移,都会带来不同程度的监管影响[3,4]。在不同阶段技术转移过程中,人员、设备、物料、生产工艺和清洁方法、环境和检测方法等变更会对产品的安全性、有效性和质量可控方面产生影响,均对不同阶段的技术转移前后变更可比性研究进行了要求[4,5,6]。法规要求,从业者应具有足够的知识积累,具备风险识别、风险评估和风险管控的能力,并关注以下考量点选择适合的CDMO公司进行技术转移。
- 过程控制、放行检验、扩展的表征研究、强制降解/加速和长期稳定性研究
在药品临床试验阶段,技术转移前后因场地、工艺、设备、物料等因素引起的变更大多涉及产品的药学研究,可比性研究通常从过程控制、放行检验、扩展的表征研究、强制降解/加速和长期稳定性等方面全面评估工艺控制能力和药物质量。
- 非临床/或临床桥接研究
若技术转移后的变更对临床试验产生重大影响,还需要考虑开展非临床和/或临床桥接研究,如新主种子批变更、特殊辅料变更、延长减毒活疫苗生产用毒种代次、重新亚克隆筛选等。当产品上市后,当特定质量属性与安全性和有效性之间的关系尚未确定,且观察到变更前后产品的质量属性存在差异的情况下,也应实施非临床/或临床桥接性或确证性研究。
- PK/PD和毒理数据研究
若技术转移可比性结果显示药学变更对临床试验的安全性或有效性可能产生负面影响(如改变免疫原性、产生新杂质等),或当仅用药学分析数据无法排除变更可能对有效性和安全性的负面影响时,可能需要包括 PK/PD 和毒理数据在内的非临床研究,甚至需要进行变更前后的临床桥接研究。
- 生产工艺、质量及稳定性数据研究
当产品上市之后,通过对技术转移前后产品的生产工艺、质量及稳定性数据进行药学可比性研究,判定技术转移前后是否可比。
04 总结
鼎康生物作为CDMO公司,在过去十数年的技术转移服务中累计了大量的案例经验。截至2024年,鼎康生物已经完成40多个技术转移项目,其中一个成功获批上市许可、多个项目获批用于中美欧的II期/III期临床试验。公司遵循正确的技术转移流程及开发策略,且其已被证明对于完成不同项目里程碑均是非常有效的。例如,在技术转移启动阶段,鼎康生物迅速成立合适的项目团队和基于联合CMC会议的沟通渠道,剖析所在项目技术转移发生的复杂性;丰富的制造流水线也使得鼎康生物能够承接例如50L、200L、 500L及2000L等不同规模的技术转移。
此外,鼎康生物还拥有全球首个符合国际标准(FDA、EMA、NMPA)的模块化大分子生物制药工厂,并已通过欧盟QP的GMP符合性审核,高品质质量体系可为技术转移的对比性研究保驾护航。现阶段的鼎康生物能够承接研制生命周期中任何阶段的技术转移服务,是众多转移方的首选合作伙伴,能帮助需求方真正实现优化药物研制时间、节约商业化成本、把控药物开发风险的目的。
参考文献
1.ICH Q10.,Expert Working Group.ICH Q10: Pharmaceutical Quality System[EB/OL].2008.
2.Tech Transfer for Biopharmaceutica Manufacturing, A Live, Online Training Course That Thomas Chattaway Delivers For BioProcess International Academy Https://lnformaconnect.Com/Biopro cess-International-Academy
3.WHO Guidelines on Transfer of Technol- ogy in Pharmaceutical Manufacturing World Health Organization: Geneva, Swit- zerland, 2011; https://www.who.int/med icines/areas/quality_safety/quality_as surance.
4.ICH Q5E: Comparability of Biotechno logical/Biological Products Subject to Changes in Their Manufacturing Process International Council for Harmonisation of Technical Requirements for Pharma- ceuticals for Human Use: Geneva, Switzer and,2004;https://data base.ich.org/sites/default/ files/Q5E%20Guideline.pdf.
5.临床试验期间生物制品药学研究和变更技术指导原则(征求意见稿)
6.已上市生物制品药学变更研究技术指导原则(试行)
关于鼎康生物
鼎康生物是一家全球领先的CDMO公司,率先引进了全球首个模块化生物制药工厂KUBio,赋能生物制品从细胞株开发到商业化生产的全过程。我们位于上海的创新中心聚焦高效的细胞株开发和先进的技术开发,与拥有多国临床试验申请和新药上市成功经验的武汉制造工厂相结合,鼎康生物正在为全球生物医药客户提供一站式的CMC解决方案。在鼎康生物,我们有一个共同的目标, 致力于提高前沿生物医药对全球患者的可及性,履行我们对人类健康的承诺。如需了解更多信息,请访问: www.chimebiologics.com。


