CHO细胞株开发:流程与关键技术点概述

生物药和诊断试剂作为制药市场上增长迅速的产品,受到了人们的关注和广泛的应用。其中包括了各种单克隆抗体(mAb)、重组蛋白疫苗、激素和其他蛋白质类产品,随着这些生物制剂越来越多地进入市场,这个数字还在不断增长。近几年,平均每年有15 种以上重组蛋白新药通过美国食品药品监督管理局(FDA)批准,并且在几个重磅生物抗体药专利即将到期促使生物仿制药出现的刺激下,全球生物抗体药销售额已超过1800亿美元每年。
01 CHO细胞的优势
哺乳动物细胞是临床抗体药物产品使用的主要表达系统。对于治疗性抗体而言,为了满足其生物活性,需要进行正确的折叠和翻译后修饰,因此用于生产治疗性抗体的宿主细胞往往是哺乳动物细胞,主要包括:Sp2/0 骨髓瘤细胞、NS0 小鼠骨髓瘤细胞、HEK293人胚胎肾细胞和中国仓鼠卵巢细胞(Chinese hamster ovary,CHO),其中以CHO细胞用途最为广泛。
与其他表达系统相比, CHO表达系统占有很大优势:
- 更适用于悬浮培养,可以满足大规模工业生产重组蛋白的要求
- 产生的抗体分子在结构、功能方面和天然抗体分子较接近
- 所含人类病毒极少
- 外源基因可以在CHO细胞中稳定地整合
- CHO细胞是成纤维细胞, 几乎不分泌内源性蛋白, 因此对目标重组抗体的分离纯化工作十分有利
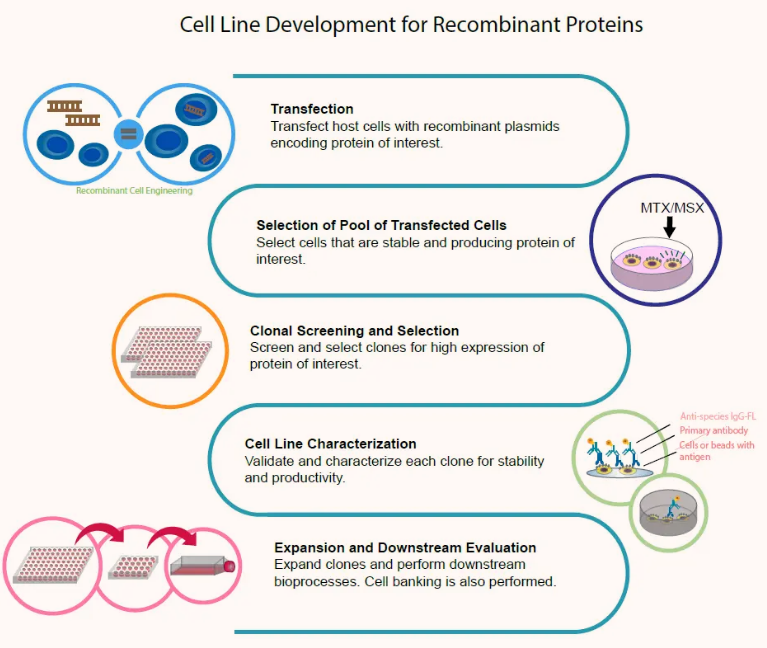
CHO细胞株开发流程图
02 CHO细胞株开发过程中的关键技术点
- 表达载体的构建与转染
细胞株开发阶段是从高表达的基因优化开始,然后将目的基因插入CHO宿主细胞中。常见的转染方式主要有磷酸钙转染、电穿孔转染、脂质体转染和逆转录病毒转染。DNA进入宿主细胞核后将会随机整合到宿主细胞基因组中,因此其表达水平与基因拷贝数、基因整合位点的转录活性有关。被筛选出来的克隆经过传代培养和分批补料(fed-batch)实验,比较其生长特性、代谢状况、表达量高低、表达产物质量等因素,选出最优的几个克隆进入生物反应器放大实验,最终确定生产用单克隆细胞株。
适合于CHO细胞表达的载体(Vector)的基本元素包括: 启动子(promoter)、poly A加尾信号(poly A signal)、筛选标记( selectable marker)、克隆位点(cloning site)和复制起始位点(origin of replication),有些还有报告基因( reporter gene)。启动子一般较多采用SV40和CMV两种,CMV启动子通常位于目的基因(轻链和重链可变区基因)之前,而SV40则位于筛选标记之前。筛选标记一般有两种:代谢型和抗生素型,或者也可称为扩增型基因筛选标记和非扩增型基因筛选标记。常见的筛选标记见下表,当前工业界较多采用的筛选标记为DHFR、GS、G418和puromycin等。
|
|
|
|
|
(扩增型基因筛选标记) |
|
|
|
|
|
|
|
(非扩增型基因筛选标记) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 转染方法
转染类型一般有稳定转染和瞬时转染两种。在单抗细胞株筛选稳定转染前通常通过瞬时转染得到一些抗体,进行质量分析,以初步判断抗体是否满足需要,或者进行一些前期的启动子、密码子等组件的优化。稳定转染中外源DNA既可以整合到宿主染色体中,也可能作为一种游离体存在。在CHO细胞中进行稳定转染时,外源DNA整合到CHO染色体上,未整合的游离态的DNA会随传代而丢失。
常用于哺乳动物细胞转染的方法有磷酸钙法、阳离子脂质体法、阳离子聚合物法和电穿孔法,使用最多的是阳离子脂质体法和电穿孔法。磷酸钙法是借助DNA-磷酸钙复合物沉淀黏附在细胞膜表面,通过细胞的内吞作用而使DNA被细胞捕获。沉淀颗粒的大小和质量对于转染的成功至关重要,也受pH值、钙离子浓度、DNA浓度、沉淀反应时间、细胞孵育时间等因素影响。磷酸钙法可适用于稳转瞬转,操作简便花费相对较低,但转染效率低,10-20%,并且重复性很差。阳离子脂质体法使用带正电的脂质体与带负电的核酸磷酸基团形成DNA-阳离子脂质体复合物,再与细胞膜上的唾液酸残基的负电核结合,可能经过内吞作用被导入细胞。该方法使用简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,转染效率、转染的稳定性和可重复性大大提高。但转染时需要去除血清,血清的缺失会导致细胞毒性增加,转染效果也随细胞类型变化较大。阳离子聚合物法使用带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。阳离子聚合物法具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内转染效率高,细胞毒性低等特点。电穿孔法,也就是电转,无论是在操作方法、适用范围以及转染效率等方面,都有着很大的优势。而现实亦是如此,由于电转的高效、低内毒、操作简单,并且可以瞬时和稳定地表达外源基因,因此常常用于科研领域的新药开发、癌症研究、免疫学研究等。
- 高表达细胞株的筛选
筛选高表达单克隆细胞株是细胞株构建的关键步骤,衡量标准包括抗体表达量、产品质量、代谢稳定性、细胞稳定性等。当目的基因被转染到宿主细胞内,并按照一定的细胞密度在合适的筛选压力下进行传代培养后便得到了细胞池。细胞池的表达量取决于转染的方式、筛选压力的作用以及目的基因整合情况。由于目的基因整合具有很大的随机性,即使用相同的方法进行转染和筛选,表达量依然会体现出极大的差异性,接下来就要从细胞池中筛选出高产稳定的细胞株。
CHO细胞转染之后,通常会做一个克隆池(pool),然后进行筛选。筛选策略主要涉及抗生素或药物的代谢途径,常见的筛选试剂包括puromycin、G418、MTX和MSX等。Puromycin为氨基糖甙类抗生素,通过干扰核糖体功能阻断哺乳动物细胞的蛋白质合成,来自链霉菌的pac基因具有解除嘌呤霉素(puromycin)毒性的作用,在筛选的时候,puromycin浓度一般在10~50ug/ml;G418也是一种氨基糖苷类抗生素,是稳定转染最常用的抗性筛选试剂之一,G418在筛选的时候一般浓度范围为200~1000ug/ml;MTX为叶酸拮抗剂,在细胞内经过转换后可抑制DHFR的活性,抑制核酸合成,引起细胞毒性。Schimke等的研究显示,随着MTX浓度的增加,绝大多数细胞死亡,但在极少数幸存下来的抗性细胞中,DHFR基因得以扩增,目的基因拷贝数随之增加,提高了表达量。MTX筛选时,一般浓度范围为25~1000 nmol/L;MSX筛选采用的是谷氨酰胺合成酶基因GS系统压力,谷氨酰胺合成酶(GS)扩增系统是新近发展的更有效的系统,具有更高的扩增效应。MSX筛选时,一般浓度范围为25~500 umol/L。
常用的筛选克隆的方法包括:有限稀释法(limiting dilution cloning,LDC)、流式细胞仪分选法(fluorescence activated cell sorter,FACS)、单细胞打印技术、半固体培养基筛选法等。
有限稀释法
有限稀释法因为其低成本和易于操作,曾广泛运用于克隆的筛选。该法是将细胞稀释到极低的细胞密度,并将稀释好的细胞置于96孔板中培养,使孔板中每个孔的理论细胞数小于1个,稀释后使用显微镜对96孔板整板拍照,以确保单克隆。经过一段时间的培养后使用酶联免疫吸附反应选取表达量高的细胞扩大培养。有限稀释法往往需要重复两次,以确保单克隆细胞株的纯度。
流式细胞仪分选法
将带有荧光标记的二抗和分泌抗体的CHO细胞混合孵育,分泌到细胞表面的抗体就能够被流式细胞仪检测到,从而利用其分选功能筛选出分泌多的细胞。为了使分泌到胞外的抗体能够维持在细胞膜表面,还可以使用微囊将细胞以及分泌的抗体包裹起来。目前,又有新的方法运用于流式细胞仪分选,即将绿色荧光蛋白(green fluorescent protein,GFP)的两个基因片段作为报告基因分别构建到抗体重链和轻链的表达载体上进行共转染,当这两个片段都整合到细胞内进行表达时,能够产生绿色荧光蛋白而发出绿色荧光,利用FACS进行分选得到高表达的细胞。使用该方法在转染完成后48h就能够进行检测,可以有效缩短克隆筛选的时间,提高实验效率。
单细胞打印技术
将细胞检测传感器和按需滴定印刷技术相结合。过程类似于传统的喷墨打印机。从液体样品中温和而精确地分离单个细胞,确保细胞的活力,提高了克隆生长率。使用无菌的,一次性的打印墨盒避免了交叉污染。大大提升药品的开发进程。
稳定重组细胞株开发过程中的一个重要问题是生成和鉴定高产克隆,这些克隆不会随着时间的推移而失去表达能力。(克隆性在治疗性蛋白质生产中至关重要,因为克隆谱系可以提供稳定且一致的产品质量。)然后需要在长期培养过程中对选定克隆的生产进行评估,这是一个劳动密集型且耗时的过程。然而,CHO细胞株上快速积累的转录组数据为功能分析开辟了新道路,可以通过确定高产量和克隆稳定性的调节因子和生物标志物来进行筛选。
鼎康生物为客户提供自主知识产权的和高表达的CHO表达系统并将其集成到细胞株开发工艺中,既快速又高效
鼎康生物可以利用许多技术来加速细胞株的开发。高通量技术,如亲和捕获技术,通过使用自动化来加速细胞分离、筛选和选择。使用单细胞打印技术以及先进的人工和机器学习自动化进行分拣可以进一步提高生产速度。CHO细胞株上快速积累的转录组数据为功能分析开辟了新道路,可以通过确定高产量和克隆稳定性的调节因子和生物标志物来进行筛选。采用这种方法,通过分析低产和高产CHO克隆的基因表达谱,找到工程细胞的潜在靶标,从而使克隆选择更快、更高效。鼎康生物可以为客户的候选分子快速制备稳定细胞池,进行成药性分析。客户确定分子后,稳定细胞池可立即用于单克隆筛选,缩短IND所需时间。单抗稳定细胞池表达量可大于5g/L。
目前,大量工程化、复杂的重组蛋白正在不同的研究管线进行开发和研制。尽管大家都在使用先进的CHO细胞表达平台,但有些蛋白质在许多情况下被证明是“难以表达”(difficult to express,DTE)。制药行业创新研究的一个主要领域集中于提高这些生物产品的可制造性。要解决的关键问题是转录水平的表达优化,其中涉及表达构建体设计、基因组整合方法以及与整合位点基因组环境的相互作用。即使在充分表征的整合位点上,重组蛋白的转录水平也会受到整合位点和表达组件之间相互作用的影响。对这种现象的研究对于可编程细胞来说是非常必要的,以便能够预测多个成分如何促进插入转基因而表达。
位于上海张江科学城的鼎康生物创新中心(Chime Biologics Innovation Center),专注高效的细胞株开发和先进的技术开发。与拥有多国临床试验申请和新药上市成功经验的鼎康生物武汉制造工厂相结合,致力于打造国际领先的生物药物研发中心。目前鼎康生物高产、快速、稳定的细胞株开发,基于具有自主知识产权的和高表达的CHOrus平台。鼎康生物可以提供直接用于CMC大规模生产的稳定细胞株开发服务,其CHO K1细胞株来源清晰,表达量高,可以全球亚授权。采用先进的单细胞打印机和高分辨率成像系统,以确保单克隆细胞的单一性和缩短筛选的时间。根据法规要求,细胞株生产和单克隆性都有完整的记录和可追溯性,表达量可超过10g/L。
作为领先的生物药CDMO 企业,鼎康生物已经是市场上屈指可数能做商业化生产的CMO, 可以为单抗、双抗、疫苗、融合蛋白等生物制品提供商业化原液生产服务以及无菌灌装服务。如今,位于上海的鼎康生物创新中心在缩短药物上市时间方面发挥着关键作用,团队快速地建立高产的稳定细胞群,用于蛋白材料的生产和单细胞克隆,以实现更快的交付,为IND申请提供了更快、更有效的途径,推动项目开发并加快商业化时间表。
关于鼎康生物
鼎康生物是一家全球领先的CDMO公司,率先引进了全球首个模块化生物制药工厂KUBio,赋能生物制品从细胞株开发到商业化生产的全过程。我们位于上海的创新中心聚焦高效的细胞株开发和先进的技术开发,与拥有多国临床试验申请和新药上市成功经验的武汉制造工厂相结合,鼎康生物正在为全球生物医药客户提供一站式的CMC解决方案。在鼎康生物,我们有一个共同的目标, 致力于提高前沿生物医药对全球患者的可及性,履行我们对人类健康的承诺。如需了解更多信息,请访问: www.chimebiologics.com。


